Окисление молочного жира и фосфолииидов молока вызывается ферментами, но чаще происходит химическим путем — под действием кислорода воздуха и света. Как правило, окисление липидов снижает биологическую ценность молока и молочных продуктов и часто вызывает их порчу.
Перекисное окисление жира. Под окислением жира следует понимать его глубокий распад с образованием перекисей (пероксидов), альдегидов, кетонов, оксикислот и других соединений, которые очень часто приводят к появлению в молочных продуктах нежелательных привкусов и запахов.
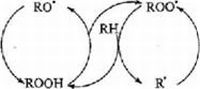
Перекисное окисление происходит в результате взаимодействия жира с молекулярным кислородом. Окислению подвергается в первую очередь свободный жир, не защищенный оболочкой, а из жирных кислот преимущественно окисляются ненасыщенные. Окисление свободных и свйзанных жирных кислот молекулярным кислородом проходит через цепные реакции с образованием промежуточных продуктов пе- рекисного типа. Существенную роль в начальной стадии перекисного окисления играют свободные радикалы — радикалы, один из атомов которых имеет свободную валентность. Теория свободнорадикальных ценных реакций окисления липидов разработана акад. Н. Н. Семеновым на основе теории перекисного окисления Баха—Энглера.
Согласно современным представлениям образование свободных радикалов, приводящих к зарождению {инициированию) цепи окисления, происходит при отрыве атома водорода от реагирующей молекулы вещества (жир, жирная кислота): RH R’ + Н. Инициатором цепных реакций могут быть металлы, кислород, ферменты, свет, различные типы излучения (ультрафиолетовое, радиация и др.) и Т. II.
Далее активный радикал R вступает в реакцию с молекулярным кислородом, образуя пероксидный радикал R’ + О, ROO’. Перок- сидный радикал, реагируя с новой молекулой окисляемого вещества, дает гидроперекись (гидропероксид) и новый свободный радикал ROO’ + RH – г ROOH + R*.
Образовавшийся свободный радикал R" вновь реагирует с кислородом, то есть происходит продолжение (развитие) цепи*:
+ о, + кн R"— ^ROO’ jfc – ROOH + R’ и т. д.
Молекулы гидропероксидов в свою очередь распадаются с обра» зованием новых свободных радикалов: ROOH R0′ + ‘ОН. Когда концентрация гидропероксидов повышается, происходит их распад с образованием еще большего числа радикалов: 2ROOH —» ROO’ + R0" + HjO. Эти радикалы способствуют зарождению новых цепей окисления, вызывая тем самым самоускорение процесса окисления жира.
Таким образом, окисление жиров молекулярным кислородом можно представить схематически следующим образом (по Уильямсу):
* Свободные радикалы могут таюке взаимодействовать с другими радикалами, образуя стабильные продукты я вшивая обрыв цепи окисления: R’ + R’ – t KR, R’ + ROO’ -+ ROOR. Анало гично обрывают цепь оклелення антиоксиланты.
Скорость окисления жира в первую очередь зависит от состава жирных кислот триацилглииеринов (причем свободные жирные кислоты окисляются быстрее связанных). Насыщенные жирные кислоты окисляются медленнее ненасыщенных, а полиненасыщенные — быстрее мононенасыщенных, что объясняется различной скоростью образования ими свободных радикалов.
Окисление ненасыщенной жирной кислоты можно представить следующим образом. Вначале кислота под влиянием свста или другого инициатора образуется свободный радикал
R-CH2-CH=CH-R2—СООН R|-CH-CH=CH-RJ-COOH.
Свободный радикал взаимодействует с кислородом, образуя пе – роксидный радикал
R^Ii—СН=СН—R^COOH + Ог———— — R, СН-СН=СН-R^COOH.
У-6
Пероксидный радикал отщепляет атом водорода от другой молекулы ненасыщенной жирной кислоты, обра^я гидропероксид и новый свободный радикал, который продолжает цепную реакцию
RjCH-CH-CH-RjCOOH + RнCH-CH=CH-RMCOOH———————
O-У
—— ^R1CII-CH=CH-R^COOH + R3CH-CH=CH-R4COOH.
О-он
Следовательно, на первой стадии окисления образуются различные пероксиды и гидропероксиды, являющиеся неустойчивыми и высокоактивными соединениями. Первичные продукты окисления существенно не влияют на органолептические свойства продуктов. После их накопления в жире начинают протекать разнообразные реакции, в результате которых образуются вторичные продукты окисления, часто обладающие неприятным вкусом и запахом, — альдегиды, кетоны, моно – и дикарбоновые кислоты, эпоксиды, окси – сосдинения и т. д.
Одним из возможных механизмов, приводящих к образованию наиболее характерных продуктов окисления — альдегидов, является распад гидропероксидов иди циклических пероксидов кислот по схеме
Яг-СН2-СН-СН-СН2-К2–СООН—»-
I I
О—О р
— л,—СН2-С + С"СН2-^-СООН / н н
Альдегид
В результате распада образуются два альдегида, молекулярные массы которых меньше массы исходной кислоты. Образование насыщенных и ненасыщенных кетонов (и кетокислот) можно представить как результат дегидратации гидроксидов
| ~н20 1 1 II *
Он о
Кеток (или кето кислота.)
Образование оксисоединений (дигидроксисоединений) может происходить при распаде циклических пероксидов
+ 2Н20
Я-СН2-СН-СН-СНг^2—- к-сн2-сн-сн-сн2-к2+ Н202
О—О ОН ОН
Дигидроксисоединение
Таким образом, при окислении олеиновой и полиненасыщенных кислот могут образоваться низкомолекулярные насыщенные альдегиды — пентаналь, гексаналь, гептаналь, октаналь, нонаналь, малоновый диальдегид и другие мононенасыщенные и диненасы- щенные альдегиды — пентен-2-аль, октен-2-аль, гептадиен-2,4-аль, декадиен-2,4-аль, а также насыщенные и ненасыщенные кетоны (С5,мС15). Многие из перечисленных альдегидов и кетонов обладают неприятным вкусом и в различных комбинациях могут придавать молочным продуктом посторонние привкусы. Так, рыбный привкус вызывают насыщенные и ненасыщенные альдегиды (С5…СП), главным образом гексаналь, гептанальи гептадиен-2,4-аль; прогорклый — гепганаль и нонаналь; салистый — пентаналь, гексаналь, пенген-2-аль {и дигидроксистеариновая кислота). Ненасыщенный кетон октен-1-он-З (виниламилкетон) является виновником металлического привкуса молочных продуктов, а кетон пептен-1-он-З — олеистого привкуса.
Состав образующихся продуктов и скорость окисления жира молекулярным кислородом зависят от целого ряда факторов: химического состава жира, температуры хранения, влажности и т. д. На процесс окисления жира влияют некоторые химические вещества, которые либо ускоряют его (прооксиданты), либо замедляют (антиокси – данты).
Скорость окисления жира увеличивается при повышении температуры, влажности, доступе в реакционную среду кислорода воздуха, света и т. д. Сильно ускоряют окисление жира металлы переменной валентности (Cu, Fe, Со, Мп и др.), которые относятся к основным прооксидантам. Их ускоряющее действие может заключаться, во-первых, в инициировании цепей окисления; во-вторых, возможный механизм ускорения окисления жиров может заключаться в катализи- ровании процесса распада гидропероксидов, продукты которого дают начало новым цепям окисления:
ROOH + Fe2+——– >~ RO’ + ОН" + FeJ%
RO’ + RH——— ROH + R’———— Цепное окисление
Металлы проявляют прооксидантное действие только при малом содержании, в больших концентрациях они могут обрывать цепи окисления и замедлять окисление жира.
Задержку’ окислительной порчи продуктов вызывают так называемые антиоксиданты, или антиоки&штели. Действие ан-гиоксидан – тов заключается во взаимодействии со свободными радикалами, ведущими цепи окисления. В результате этого происходит обрыв цепей окисления и на какой-то период времени задерживается процесс самоокисления жира:
ROO’ + АН——– ROOH + А’
Или R – + АН——- RH + А",
Где А — антиоксидант.
Из приведенных реакций видно, что активные свободные радикалы ROO" и R" заменяются на малоактивные радикалы аити – оксиданта А". Последние подвергаются димернзации или вступают в реакцию с другими радикалами, образуя неактивные продукты:
А’+А—- A’+R————— – RA
Или А’ + ROO*———- ROOA
Известно большое количество соединений, обладающих сильными антиоксидантными свойствами. Одни из них содержатся в пищевых продуктах (естественные, или природные антиоксидан – ты), другие получают искусственно и вносят в продукты (синтетические антиоксиданты). Среди естественных антиоксидантов наиболее активными являются токоферолы, содержащие подвижный атом водорода, который может взаимодействовать со свободными радикалами R’. При потере атома водорода токоферолы образуют малоактивные радикалы, прерывающие цепь окисления:
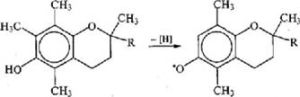
К менее активным природным антиокислителям относятся аскорбиновая кислота, 8Н-соединения, р-каротин, лецитин и др. Кроме того, некоторые соединения могут усиливать действие естественных антиоксидантов. К таким соединениям, называемым си – нергистами, относится лимонная кислота, а также аскорбиновая и винная кислоты, лактаты калия и натрия, фосфолипиды. Их синер – гетическое действие заключается в восстановлении окисленных форм антиоксидантов или в связывании ионов тяжелых металлов в неактивные комплексы.
Из синтетических антиоксидантов наибольшую активность имеют соединения фенольноготипа — эфиры галловой кислоты (пропил галл ат, октилгаллат, додецилгаллат и др.), бутилгидрок – сианизол (БОА), бутилгидрокситолуол (БОТ, ионол), кверцетин и др.
До недавнего времени синтетические антиокислители в РФ использовали только для защиты кулинарных, животных (свиного, говяжьего и др.) и рыбьих жиров, сухого молока. В настоящее время появился отечественный антиоксидант тонарол (4-метил-2,6-ди’фетбугил-фе – нол, аналогионода), который разрешено Госкомсанэпиднадзором вносить в сливочное масло для повышения ею хранимоспособности.
Окисление фосфолипидов. Фосфолипиды относительно легко окисляются кислородом воздуха, особенно при наличии в молоке и молочных продуктах солей тяжелых металлов. В первую очередь окисляются фосфолипиды, находящиеся в плазме молока, затем — фосфолипиды оболочек шариков жира. Активное окисление фосфолипидов обусловлено высоким содержанием в их молекулах полиненасыщенных жирных кислот — линолевой, линоленоаой и арахидоно – вой. Данные жирные кислоты окисляются кислородом воздуха с образованием пероксидов и карбонильных соединений, вызывающих ухудшение органолептических свойств молочных продуктов.
Как известно, фосфолипиды являются важными структурными компонентами оболочек шариков жира, поэтому их окисление будет способствовать дестабилизации жировой фазы и лучшей атакуемо – сти жира кислородом воздуха.
Окислительная порча молочных продуктов. Возникновение пороков вкуса и запаха вследствие развития окислительных процессов характерно для молока (сырого и пастеризованного), сливочного масла, сухих молочных продуктов. В других продуктах (сгущенное молоко с сахаром, сгущенное стерилизованное молоко, некоторые виды сыров, сметана, творог и др.) интенсивность образования данных пороков невысокая и возрастает лишь в результате длительного хранения, особенно при воздействии кислорода и света.
Окисление липидов молока. В процессе длительного хранения молока при низких температурах, а также под воздействием светового излучения с длиной волны менее 500 нм в продукте возникают окисленные привкусы — «картонный» и «солнечный», которые иногда сопровождаются металлическим, рыбным и салистым привкусами. Окисленные привкусы молока обусловливаются образованием альдегидов (этан ал я, пропаналя, метионаля, пентакаля и др.), метилке – тонови спиртов.
Развитие окисленного привкуса в молоке ускоряют дестабилизация жировой фазы, ионы меди, железа, аскорбиновая кислота в малых концентрациях.
Дестабилизированный (свободный) жир содержит больше поли – ненасышенных жирных кислот по сравнению с обычным жиром, поэтому скорость его окисления в 1,5„.3 раза выше. Количество свободного жира в молоке зависит от времени года, степени механического воздействия при хранении и других факторов.
Как известно, металлы являются основными прооксидантами, ускоряющими окисление липидов. Прооксидантными свойствами также обладает аскорбиновая кислота в малых количествах.
Предотвращению появления окисленного привкуса в молоке способствуют снижение степени механического воздействия при хранении, устранение действия света, внесение в молоко аскорбиновой кислоты (в количестве 25…50 мг на 1 кг), р-каротина, низина, пастеризация при высоких температурах и гомогенизация молока.
Окисление сливочного масла. Образование пероксидов, альдегидов, кетонов, оксикислот и других соединений при окислении липидов сливочного масла в процессе выработки и особенно при хранении приводит к снижению его качества, биологической ценности и возникновению пороков вкуса и запаха — салистого, прогорклого, рыбного, металлического и олеистого. Границы перекисных чисел для молочного жира не установлены. Как показывает практика, перекис – ные числа стойкого молочного жира (масла) находятся в пределах от 0,03 до 0,08% I, (или немного выше), 11ри окисленности жира по пробе на содержание малонового диальдегида с 2-тиобарбитуровой кислотой (2-ТБК) образны молочного жира считаются свежими при величине оптической плотности (при длине волны 535 нм), равной ОД 10. ..0,064 ед. на I г жира.
Скорость и направленность процесса окисления, а следовательно, и стойкость сливочного масла при хранении зависят от многих факторов. К ним относятся: химический состав, структура масла, объем и состав плазмы, ее дисперсность, содержание в масле воздуха, металлов, хлорида натрия, молочной кислоты, естественных и синтетических антиоксидантов, вид упаковочных материалов, температура хранения.
Химический состав молочного жира значительно влияет на стойкость масла при хранении, особенно содержание в нем полиненасыщенных жирных кислот (линолевой, линоленовой и арахидоновой). Их содержание зависит от времени года {повышается весной, понижается осенью и зимой). Чаще всего нестойко при длительном хранении масло, выработанное из весеннего молока.
Окислительная порча масла протекает, главным образом, на границе фаз жир-вода, жир-воздух. Следовательно, стойкость масла при всех прочих условиях зависит от степени диспергирования влаги (плазмы) и содержания в нем воздуха. С увеличением степени диспергирования влаги устойчивость масла к процессу окисления снижается. Масло, выработанное методом преобразования высокожирных сливок, характеризуется наиболее тонким распределением влаги. Поэтому в процессе хранения при низких отрицательных температурах (-18°С) оно менее устойчиво, чем масло, полученное сбиванием сливок, характеризующееся более крупными каплями плазмы. Однако оно обладает повышенной устойчивостью при более высоких минусовых (—5*С) и плюсовых температурах, когда имеют место не только химические, но и ферментативные процессы.
Ме таллы, особенно медь, снижают устойчивость масла к окислительной порче. Установлено, что масло при содержании меди 0,4 мг/кг приобретает через 3 мес хранения (при температуре -18"С) рыбный привкус, а при количестве 1,5.,,2 мг/кг быстро снижает свое качество (Л. Н – Ловачевидр,).
К факторам, влияющим на стойкость масла при хранении, относится содержание в нем антиокислителей (антиоксидантов), задерживающих окисление жира. Масло летней выработки, богатое естественными антиокислителями (токоферолами, (^-каротином, 5Н-группами) более стойко при хранении, чем масло, выработанное зимой.
Для повышения стойкости масла при длительном хранении необходимо снижать загрязненность сливок и масла медью и железом, вносить р-каротин и синтетический антиоксиданттонарол в количестве 0,05…0,020% к массе жира, предохранить его от контакта с воздухом, светом, влагой, применять в качестве упаковочных материалов полимерные мешки-вкладыши, алюминиевую кашированную фольгу и другие газо-, свсто – и влагонепроницаемые материалы (Ф. А. Вьшгемирский и др.).
Окисление сухих молочных продуктов. Окисление липидов сухого цельного молока (СЦМ) и других сухих продуктов является одним из видов порчи, которое приводит к ухудшению их органолептических свойств и снижению биологической ценности. Окисленный, салистый и другие привкусы СЦМ могут быть вызваны большим содержанием в продукте воздуха (более 0,1%), свободного жира (выше 9%), солей меди и железа (более 10 мг/кг сухого вещества молока).
Количество воздуха в СЦМ обусловлено размерами частиц, содержание свободного жира — количеством дестабилизированного жира в сырье. Оба показателя зависят от режимов сгущения, распыления и сушки молока, скорости охлаждения продукта после выхода из сушильной башни, вида упаковки, температуры хранения и влажности воздуха и т. д.
Устойчивость сухих продуктов к окислению можно повысить пу – темвнесения антиоксидантов (сдобавлением ихсинергистов или без них) — кверцетина, эфиров галловой кислоты, бутилгидрокситолуо – ла, бутилгидроксианизола и других, а также осуществления гомогенизации сгущенного молока перед сушкой, хранения продуктов в атмосфере азота.
|



 ENG
ENG